Was ist eine Pulmonale Arterielle Hypertonie?
Pulmonale Arterielle Hypertonie (PAH) ist die Bezeichnung für Erkrankungen, welche mit einem erhöhten Blutdruck im Lungenkreislauf entstehen. Man spricht von pulmonal-arterieller Hypertonie ab einem mittleren Blutdruck von 25 mmHg; es sind jedoch Werte bis 100 mmHg möglich.
Die WHO teilt die Pulmonale ARterielle Hypertonie in fünf verschiedene Gruppen ein. Im Volksmund wird von Lungenhochdruck gesprochen.
Überblick
Im Kreislaufsystem des Menschen unterscheidet man den sogenannten „großen Kreislauf“, oder Körperkreislauf, der die Extremitäten (Arme und Beine) und Organe des Menschen mit sauerstoffreichem Blut versorgt und im venösen Schenkel sauerstoffarmes Blut aus der Körperperipherie zurück zum rechten Herz transportiert.
Die rechte Herzkammer pumpt sauerstoffarmes Blut (blau) über den Hauptstamm der Lungenarterie (Truncus pulmonalis) in die zwei Lungenarterien (Aa. pulmonales dextra et sinistra) in den „kleinen Kreislauf“, auch Lungenkreislauf genannt, damit zirkulierendes Blut wieder arterialisiert, d.h. über Sauerstoffdiffusion aus den Alveolen („Lungenbläschen“, die Endstrecke des luftzuführenden Bronchialbaumsystems) mit Sauerstoff angereichert wird, um von dort aus zum linken Herz zurückfließend wieder in den großen Körperkreislauf über die Hauptschlagader (rot) gepumpt werden kann.
Ist nun, wie bei der PAH, der Gefäßdurchmesser der zuführenden Aa. pulmonales oder der Lungenkapillaren chronisch verengt, steigt in diesen Gefäßen der Blutdruck an und dadurch muss die rechte Herzkammer (rechter Ventrikel) mehr Kraft verwenden, um genau die gleiche Menge Blut pro Minute durch den Lungenkreislauf zu pumpen. Um dies leisten zu können, benötigt er zusätzliche Muskelmasse; er hypertrophiert (vergrößert sich).
Bis zu einem gewissen Zeitpunkt bleibt diese Vergrößerung vom Patienten unbemerkt: Sie äußert sich erst, wenn der Herzmuskel so groß geworden ist, dass er von den Koronargefäßen (A. coronaria dextra) nicht mehr ausreichend mit Blut versorgt werden und daher seine Arbeit nicht mehr ausreichend leisten kann. Die rechte Herzkammer verliert an Kontraktionskraft und wird in ihrer Leistung eingeschränkt, d.h. sie wird insuffizient.
Da die sehr elastischen Lungenarterien im gesunden Zustand die Fähigkeit haben, sich bedarfsgerecht zu weiten oder zu verengen – man spricht von „Perfusionselastizität“ – können sie bei körperlicher Betätigung durch ein gesteigertes Blutflussvolumen pro Zeit durch den Lungenkreislauf den gesteigerten Sauerstoffbedarf der Muskulatur decken. Diese funktionsrelevante Perfusionselastizität ist bei der Pulmonal Arteriellen Hypertonie verloren gegangen.
Fließt nun, bedingt durch eben jene Verengung des Gefäßdurchmessers, prozentual weniger Blut durch den Lungenkreislauf, steht dem Patienten auch weniger arterialisiertes Blut und damit weniger Sauerstoff für den Körperkreislauf zur Verfügung.
Dies äußert sich in folgender Symptomatik:
- Atemnot/ Luftnot (Dyspnoe) zunächst bei Belastung, später auch in Ruhe
- generell eingeschränkte Leistungsfähigkeit, Kraftverlust
- schnelle Ermüdbarkeit, allgemeine Mattigkeit
- Blaufärbung der Lippen durch Sauerstoffmangel (Zyanose)
- Kreislaufbeschwerden (Orthostatische Dysfunktion, Synkopen)
- Geschwollene Beine (Ödembildung), manchmal betont auf das rechte Bein
Durch die mangelnde Auswurfleistung des rechten Ventrikels staut sich vermehrt Blut im Körperkreislauf zurück, was sich durch die Entstehung von Ödemen bemerkbar macht, da durch den hydrostatischen Druck vermehrt Wasser aus der Blutsäule ins Gewebe übertritt.
Häufigkeit
In Deutschland erkranken pro Jahr nur circa 1-2 Personen pro einer Million Einwohner an einer primären PAH; es ist damit ein äußerst seltenes Krankheitsbild. Die Lebenserwartung beträgt ohne Therapie circa 3 Jahre ab Diagnose.
Die sekundäre PAH ist viel häufiger.
Ursachen primäre PHT
Die primär-idiopathische PHT / familiär pulmonal-arterielle Hypertonie ist äußerst selten, der genaue Krankheitsmechanismus (Pathogenese) ist noch weitgehend unbekannt. Bei der primären PHT findet aus unklaren Ursachen ein Umbau der mittleren und kleinen Lungenarterien statt. Pathophysiologisch spricht man von einer sogenannten „ fibrotischen Media-Metaplasie“ der Lungengefäße.
Vermutlich ist sie bedingt durch ein Ungleichgewicht zwischen gefäßweitenden (NO, Stickstoffoxid, sowie Prostazyklin, PGI2) und gefäßverengenden (vasokonstriktorisch) wirkenden (Thromboxan A2 und Endothelin) Stoffen. Diese Substanzen kommen physiologischerweise ausbalanciert vor, in diesem Falle ist jedoch das Gleichgewicht ist zu den vasokonstriktorischen Faktoren verschoben.
Ursachen sekundäre PHT
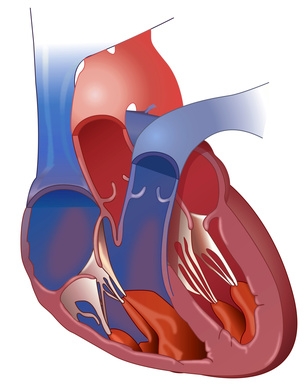
Im Vordergrund der sekundären PHT stehen akute und chronische Entzündungsprozesse im Lungengewebe und Blutgefäßen des Lungenkreislaufs oder die Verlegung der Lungenarterien durch eine Embolie bzw. wiederholte Embolien bei Bein- oder Beckenvenenthrombose.
In der akuten Phase dominiert die mit einer Entzündungsreaktion einhergehende initiale Gefäßverengung (Vasokonstriktion). Mit der Zeit kommt es zu einem Umbau der elastischen Fasern der Aa. pulmonales und des Lungengewebes (Remodeling/ Metaplasie) zu derbem, vernarbtem Bindegewebe, dessen feste Architektur es nicht erlaubt, steigendem Flussvolumen und dem damit steigenden intravasalen Druck bei Belastung nachzugeben. Man spricht nun von „fixiertem Hochdruck“ bzw. einer sekundär-chronischen PHT, da jene Umbauprozesse nicht mehr reversibel sind.
Ursachen dieser chronifizierenden inflammatorischen Prozesse sind meistens:
- Rauchen
- Inhalation toxischer Dämpfe
- COPD (Chronisch-Obstruktive Lungenkrankheit, Chronic Obstructive Pulmonary Disease)
- rezidivierende Bronchitiden
- chronische Staubexposition
- Mangel an α-Antitrypsin
Die akute Verlegung der Lungenstrombahn durch eine große Embolie führt zu einer hohen Druck im Truncus pulmonalis und abhängig von dem Ausmaß der Embolie zu einem akuten Versagen der Pumpfunktion der rechten Herzkammer (akutes Rechtsherzversagen). Der Embolus kann sich in kleinere Stücke auflösen und in die Peripherie gespült werden. Diese Stücke verschließen mittelgroße Gefäße oft komplette, so dass es zu einer Verminderung des Gesamtquerschnitts der Lungengefäße kommt, was gleichbedeutend mit einem Anstieg des pulmonalen Blutdruckes ist. Auch können wiederholte kleinere Embolien zur gleichen Konstellation führen.
Zusätzlich können folgende kardiale Erkrankungen zur Entstehung einer sekundären pulmonal-arteriellen Hypertonie führen:
- Ventrikelseptumdefekt (VSD)
- Double-Outlet Right Ventricle (DORV)
- Atrio-ventrikulärer Septumdefekt (AVSD)
- Vorhofseptumdefekt (ASD; meist symptomlos in den ersten Lebensjahrzehnten)
- Lungenvenendysplasie; v.a. eine Falschanlage der Mündungen
- persistierender Ductus arteriosus Botalli (PDA)
- Truncus arteriosus communis (TAC)
- Aorto-pulmonaler Shunt
Was Sie selbst tun können
Wenn Sie
- sich zunehmend müde und erschöpft fühlen
- Ihre sportliche oder alltägliche Leistungsfähigkeit eingeschränkt ist
- Sie unter Luftnot leiden
kontaktieren Sie Ihren Arzt.
Was kann Ihre Ärztin tun?
Ihre Kardiologin wird Sie zu Ihren Beschwerden exakt befragen und eine ausführliche körperliche Untersuchung durchführen. Darüber hinaus werden je nach Situation weitere Tests und Untersuchungen durchgeführt:
- Lungenfunktionsdiagnostik
- EKG (Elektrokardiogramm) des Herzens zur Abschätzung der (Rechts-)Herzfunktion
- Echokardiografie (sonographische Untersuchung des Herzens) und Belastungs-Echokardiografie (Stress-Echokardiographie)
- Blutbild zur Bestimmung der Entzündungsparameter, sowie der BNP-Konzentration (Peptidhormon, das bei Myokardinsuffizienz von den Herzmuskelzellen gebildet und sezerniert wird)
- Röntgenologische Darstellung des Thorax
- Herzkatheteruntersuchung zur exakten Blutdruckbestimmung im rechten Herzventrikel und in den Lungenarterien.
- Lungenbiopsie
- bei Befund: Vasoreaktivitätstest – hier wird ein Ansprechen auf die gefäßweitende Substanz NO (Stickstoffmonoxid) getestet, um abzuklären, ob eventuell gefäßweitende Pharmaka Therapieerfolg versprechen.
Therapie
Therapeutisch steht zunächst die Beseitigung der ursächlichen Erkrankung im Vordergrund, um der Entstehung einer sekundären fixierten PAH vorzubeugen. Ist dies nicht mehr ausreichend möglich, kann palliativ-medikamentös die Lebensqualität Betroffener deutlich verbessert werden.
Hierzu orientiert sich die Therapie an der NYHA-Klassifikation, einem Schema zur Klassifikation von Herzerkrankungen; auch wenn die Mitbeteiligung des Herzens nicht primär die Ursache darstellt, betrachtet man in diesem Falle sinnvollerweise Herz und Lunge als eine „Funktionseinheit“:
NYHA-Stadium:
I. Patient hat einen pathologischen Befund, ist allerdings komplett beschwerdefrei, selbst bei körperlicher Aktivität.
II. Durchschnittliche, alltägliche Aktivität induzieren Belastungssymptome, wie Luftnot, Brustschmerz, Erschöpfung bis hin zu Ohnmachtsanfällen (Synkopen). In Ruhe sind Betroffene symptomlos.
III. Bereits leichte Betätigung führt zu ausgeprägter Symptomatik. Die allgemeine Lebensqualität ist deutlich eingeschränkt.
IV. Luftnot und Schwächegefühl sind bereits in absoluter Ruhe vorhanden und werden bei Belastung verstärkt. Betroffene können keinerlei körperliche Tätigkeiten ohne Beschwerden verrichten. Das rechte Herz ist stark vergrößert und ihre Pumpleistung deutlich vermindert.
Folgende Medikamente werden bei der PAH eingesetzt:
Ab NYHA-Stadium II:
- Endothelin-Rezeptor-Antagonisten (Ambrisentan, Bosentan, Sitaxentan), ggf. in Kombination mit Iloprost
- Calcium-Antagonisten (Nifedipin, Amlodipid, Diltiazem)
- ggf. Digitalisglykoside (Digitoxin, Digoxin) und Diuretika
Ab NYHA-Stadium III:
- Prostazyklin (Epoprostenol intravenös, Iloprost inhalativ)
- Phosphodiesterase-5-Inhibitoren (Sildenafil, Tardenafil), ggf. in Kombination mit Bosentan
Natürlich ist ein Nikotinverzicht unabdingbar. Bei starker Atemnot kann vorübergehend oder dauernd mit Sauerstoffgabe eine gute Erleichterung der Atemnot erzielt werden.
In therapieresistenten Fällen besteht auch die Option einer Herz-Lungen-Transplantation.